北京時間2020年2月3日晚����,Resverlogix公告核心品種RVX-208獲得美國FDA突破性療法認定(Breakthrough Therapy Designation)���。
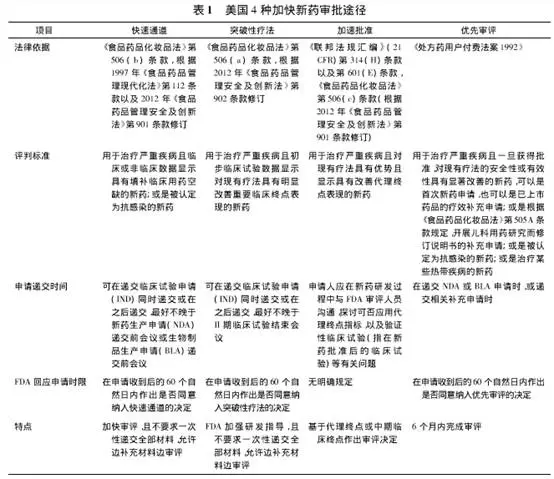
突破性療法認定(BTD)通道由美國FDA在2012年7月設立��,旨在加快用于治療嚴重疾病����、并在早期臨床研發(fā)階段展現(xiàn)良好療效的藥品的開發(fā)和注冊流程。是FDA繼快速通道(Fast Track)��、優(yōu)先審評(Priority Review)���、加速批準(Accelerated Approval)之后的第四條特別審批通道�����。
突破性療法是指被開發(fā)單用或與一種或多種其他藥物聯(lián)用于治療嚴重或危及生命的疾病����,且初步臨床試驗表明����,在一個或多個有臨床意義的終點指標上,該藥較現(xiàn)有療法有顯著改善�����,如臨床開發(fā)早期觀察到的明顯療效。
獲得BTD認定往往預示著該藥物具有較高的上市可能性以及后續(xù)享受各種利好政策支持��,根據(jù)規(guī)定���,研發(fā)中的新藥若獲得突破性療法的認定(BTD)�����,將享受一系列優(yōu)惠待遇���,包括FDA 審評人員悉心指導設計有效的藥物開發(fā)計畫,有高級管理人員參與的政策和審評資源支援�����,以及滾動審評和優(yōu)先審評的資格����,可以顯著加速新藥的上市歷程。
截止到目前為止����,心腦血管領域僅有4個品種獲得BTD資格認定����,其中Andexxa 2018年獲批上市��,RVX-208為該領域的第五個品種���;網(wǎng)絡資料顯示與中資企業(yè)相關的BTD認定僅有DKN-01(Therepeutic、百濟神州)���、JNJ-4528(楊森����、南京傳奇)��、AT-GAA(Amicus)����、BTK抑制劑zanubrutinib(百濟神州);2019年FDA累計收到156份BTD申請��,其中67份成功���,68份失敗����、21份撤銷申請,由此可見����,其稀缺性。
RVX-208與包括高強度他汀類藥物在內(nèi)的最高治療標準相結合���,可用于二級預防2型糖尿病和近期急性冠脈綜合征的主要不良心臟事件�����。與最高標準的治療療法相結合(包括高強度他汀類藥物在內(nèi))��,是滿足主要未滿足需求的一種新穎方法�。
RVX-208獲得BTD認定雖然并不是百分之百上市確保���,但一定程度上意味著其前期臨床試驗數(shù)據(jù)獲得認可���,未來成藥的可能性提高,Resverlogix與FDA的密切合作將促使高效的藥物開發(fā)計劃��,包括計劃的臨床試驗和加快的制造發(fā)展戰(zhàn)略計劃���、以及商業(yè)化�����。
我們認為���,1��、海普瑞持有Resverlogix40.03%股權,且擁有RVX-208的大中華區(qū)權益����,RVX-208獲得BTD認定,未來成藥可能性提高�,公司將直接受益;2���、海普瑞海外投資多個創(chuàng)新藥品種��,重點品種研發(fā)階段性突破激勵公司持續(xù)研發(fā)創(chuàng)新投入的同時�����,也將有助于市場投資對其管線價值的認可���,因此重申“強烈推薦評級”���。
公告連接:
https://www.resverlogix.com/investors/news?article=660
風險提示:
新藥研發(fā)不及預期、肝素粗品價格過快上漲����、海外拓展不及預期。
本文轉載自:長城證券

